平成27年度 科学技術分野の文部科学大臣表彰若手科学者賞の受賞について
平成27年4月7日
久留米大学
杉島 正一
平成27年度 科学技術分野の文部科学大臣表彰若手科学者賞 受賞課題
「ヘム代謝関連酵素の立体構造と機能に関する研究」
業績概要
酸素の運搬を担う蛋白質(ヘモグロビン)や薬物代謝、ステロイド合成に関与する酵素(シトクロムP450)などの働きに必須な有機金属色素である「ヘム」は生命に必須の分子である。赤血球の新陳代謝や溶血時には、ヘムはヘム分解酵素(HO)によって代謝されるが、その酵素反応機構には未解明な部分が多かった。また、植物などではHOの代謝物はFDBRという一連の酵素群によって、光合成色素や光受容色素へと変換される。この還元反応は基質内に生じたラジカルを利用する特異な反応であるが、この酵素についても立体構造は不明であった。
氏は、動的構造を含むX線結晶構造解析や生化学的解析を通して、HOやFDBRの酵素反応機構やHO反応に必須なダイナミックな蛋白質間電子伝達機構を明らかにした。
本研究成果は、HOを標的とした創薬研究や人工光受容色素の開発につながると期待される。
主要論文:
- 「Structural basis for the electron transfer from an open form of NADPH-cytochrome P450 oxidoreductase to heme oxygenase」 Proc. Natl. Acad. Sci. USA, p2524〜2529, 2014年02月発表
- 「Crystal structure of phycocyanobilin:ferredoxin oxidoreductase in complex with biliverdin IXα, a key enzyme in the biosynthesis of phycocyanobilin」 Proc. Natl. Acad. Sci. USA, p27〜32, 2006年01月発表
主要論文1に関して
NADPH-シトクロムP450還元酵素(CPR)は小胞体膜上に存在し、シトクロムP450をはじめ、ヘムオキシゲナーゼ(HO)やシトクロムb5に還元力を提供する。シトクロムP450は種々の薬物代謝やステロイドホルモンの合成、HOはヘム代謝、シトクロムb5は脂肪酸代謝に関与するので、CPRはこれらの代謝反応に関与する重要な酵素である。CPRの変異はステロイドホルモンやコレステロールの代謝不全による骨奇形や性器の形成異常をきたす(指定難病である先天性副腎皮質酵素欠損症の一つ)。
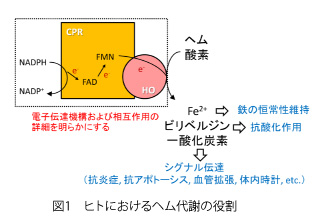 一方、HOはヘム分解経路の律速酵素であり、CPRと同様に小胞体膜上に存在する。赤血球の新陳代謝や出血時、細菌感染などによる溶血時にはヘモグロビンが分解され、それに伴って生じる遊離ヘムはHOによって、鉄、ビリベルジン、一酸化炭素へと分解される(図1)。これらの産物は図1に示した生理作用を持つため、HOはがん、循環器系疾患、マラリアなどに対する創薬ターゲットとして期待されている。また、HO遺伝子のプロモーター領域の遺伝子多型は、高血圧や大腸がん、肺気腫、アルツハイマー病など様々な疾患と関連することが知られており、HOは単なるヘム分解酵素に留まらず、種々の疾患と関わることが明らかとなりつつある。従って、CPRやHOの分子メカニズムの詳細をX線結晶構造解析などにより明らかにすることは、これらの疾患に対する創薬研究と関連する基礎研究であり、医学的にも有意義と言える。
一方、HOはヘム分解経路の律速酵素であり、CPRと同様に小胞体膜上に存在する。赤血球の新陳代謝や出血時、細菌感染などによる溶血時にはヘモグロビンが分解され、それに伴って生じる遊離ヘムはHOによって、鉄、ビリベルジン、一酸化炭素へと分解される(図1)。これらの産物は図1に示した生理作用を持つため、HOはがん、循環器系疾患、マラリアなどに対する創薬ターゲットとして期待されている。また、HO遺伝子のプロモーター領域の遺伝子多型は、高血圧や大腸がん、肺気腫、アルツハイマー病など様々な疾患と関連することが知られており、HOは単なるヘム分解酵素に留まらず、種々の疾患と関わることが明らかとなりつつある。従って、CPRやHOの分子メカニズムの詳細をX線結晶構造解析などにより明らかにすることは、これらの疾患に対する創薬研究と関連する基礎研究であり、医学的にも有意義と言える。
HOの酵素反応は、CPRからの還元力によって、ヘム鉄に結合した酸素が活性化され、その活性化された酸素がヘムを部位特異的に切断する。我々を含む国内外の研究グループの分光学的解析、結晶構造解析、量子化学計算により、ヘム鉄に結合した酸素をHOがどのように活性化され、ヘムを分解するか、また、生じた一酸化炭素がどのように放出され、酸素との競合を防いでいるかといったメカニズムがほぼ明らかとなった。しかし、酸素の活性化に必要な電子が、どのようにCPRからヘムへと受け渡されるかといった点は、CPRとHOやシトクロムP450との複合体の結晶構造が不明であったこともあり、詳細は不明であった。本研究では、変異CPRを使うことで、CPRとHOの複合体を安定化させ、 CPRとその還元相手との立体構造決定に世界で初めて成功した。この立体構造からダイナミックなCPRの構造変化を伴うHOへの電子伝達過程の詳細が明らかとなった(図2)。
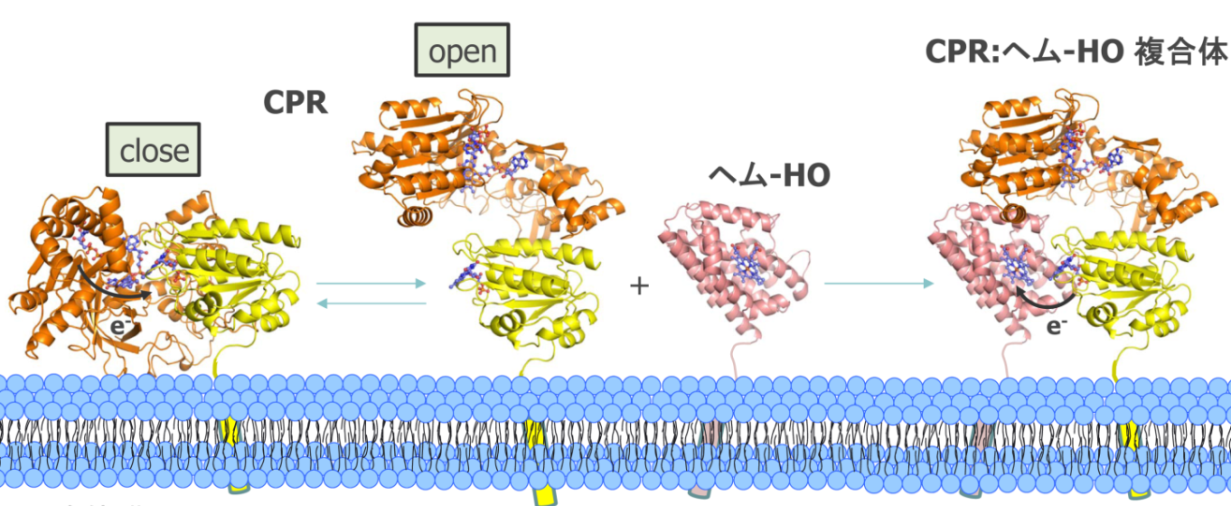
図2 大きな構造変化を伴うCPRからヘム-HOへの推定電子伝達機構。CPRはcloseとopenの平衡状態にあるが、還元されるとopen formが安定化され、ヘム-HOと結合する。CPR:ヘム-HO複合体中で電子が受け渡された後は、close formへと戻り、CPRはヘム-HOから解離する。
主要論文2に関して
哺乳類では、ヘムの代謝物であるビリベルジンはビリルビン(黄疸の原因色素、胆汁色素)へと代謝され、適量な場合、抗酸化物質として働く。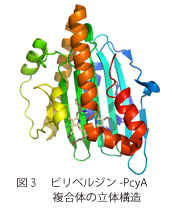 それに対して、植物やシアノバクテリアなどの酸素発生型光合成生物では、ビリルビンではなく、フィコビリン(光合成色素)やフィトクロモビリン(赤色光受容色素)へと代謝される。
それに対して、植物やシアノバクテリアなどの酸素発生型光合成生物では、ビリルビンではなく、フィコビリン(光合成色素)やフィトクロモビリン(赤色光受容色素)へと代謝される。
フィコビリンはクロロフィルの吸収できない太陽光の緑色成分を効率よく吸収する。そのため、紅藻やシアノバクテリアなどが緑色光を効率よく光合成に用いるのに必須な色素であり、地球上の光合成を担う成分の一つとして重要な位置を占めている。フィトクロモビリンは植物の「眼」として重要な色素で、種子の発芽や開花、避陰反応などに関連する。このビリベルジンからフィコビリンやフィトクロモビリンへの変換を担う酵素はフェレドキシン依存性ビリン還元酵素群(FDBRs)と呼ばれ、多様な酵素ファミリーを形成している。
本研究ではFDBRsの一つであるPcyAという酵素に基質であるビリベルジンが結合した状態の立体構造を世界で初めて決定した(図3)。本酵素の立体構造が明らかになったことにより、酵素反応機構を理解することができ、理解した反応機構をもとにフィコビリンやフィトクロモビリンを人工的に改変した色素を作成する糸口が得られた。また、これらの色素を結合するタンパク質(フィトクロム)はオプトジェネティクス分野(脳・神経系を調べるためのツールとして、光学と遺伝学を融合した研究分野)への応用が期待されており、改変FDBRsと組み合わせることで、幅広い応用が期待される。